Perbedaan Koenzim Dan Kofaktor Dalam Biologi
Pengertian Kofaktor dan Koenzim
Kofaktor Enzim adalah Enzim mempunyai berat molekul berkisar dari kira-kira 12.000 sampai lebih dari 1 juta. Beberapa enzim hanya terdiri dari polipeptida dan tidak mengandung gugus kimiawi selain residu asam amino. Enzim terdiri dari dua bagian yaitu apoenzim (tersusun atas protein) dan gugus prostetik (tersusun atas non protein),sedangkan keseluruhan enzim disebutholoenzim. Gugus prostetik ini terdiri dari: Kofaktor dan koenzim. Kofaktor terdiri dari molekul anorganik, sedangkan koenzim terdiri dari molekul organic.
Kofaktor
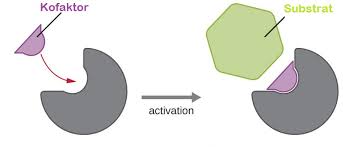
Kofaktor merupakan bahan kimia yang membantu (molekul atau ion) yang terikat enzim untuk meningkatkan aktivitas biologis enzim. Sebagian besar enzim membutuhkan kofaktor untuk mengerahkan aktivitas mereka, sedangkan beberapa enzim mungkin tidak membutuhkan mereka. Sebuah enzim tanpa kofaktor yang disebut apoenzim, yang ketika apoenzim bersama-sam dengan kofaktor ia dikenal sebagai holoenzim.
Beberapa enzim dapat mengaitkan dengan satu kofaktor sementara beberapa dapat mengaitkan dengan beberapa kofaktor. Tanap kofaktor, aktivitas enzim akan hilang. Kofaktor dapat dibagi menjadi dia sebagai kofaktor organik dan faktor co anorganik. Kofaktor anorganik terutama mencakup ion logam, magnesium sangat penting untuk heksokinase, polimerase DNA dan enzim glukosa-6-fosfat. Zinc merupakan ion logam penting bagi dehidrogenase alkohol, karbonat anhidrase dan fungsi DNA polimerase. Selain magnesium dan seng, ada ion logam lain seperti tembaga, besi, mangan, nikel dan lain-lain yang berhubungan dengan berbagai jenis enzim. Ion logam enzim dapat berpartisipasi dalam proses katalitik dalam tiga cara utama.
- Dengan mengikat substrat untuk mengarahkan dengan benar untuk reaksi.
- Dengan elektrostatis menstabilkan atau melindungi muatan negatif.
- Dengan memfasilitasi oksidasi, reaksi reduksi melalui perubahan reversibel pada tingkat oksidasi ion logam.
Kofaktor organik terutam vitamin dan molekul organik non-vitamin lain seperti ATP, glutathione, heme, CTP, koenzim B dan lain-lain kofaktor organik dapat dibagi lagi menjadi dua sebagai koenzim dan gugus prostetik. Gugus prostetik telah terikat erat dengan enzim dan berpartisipasi dalam reaksi katalis enzim.
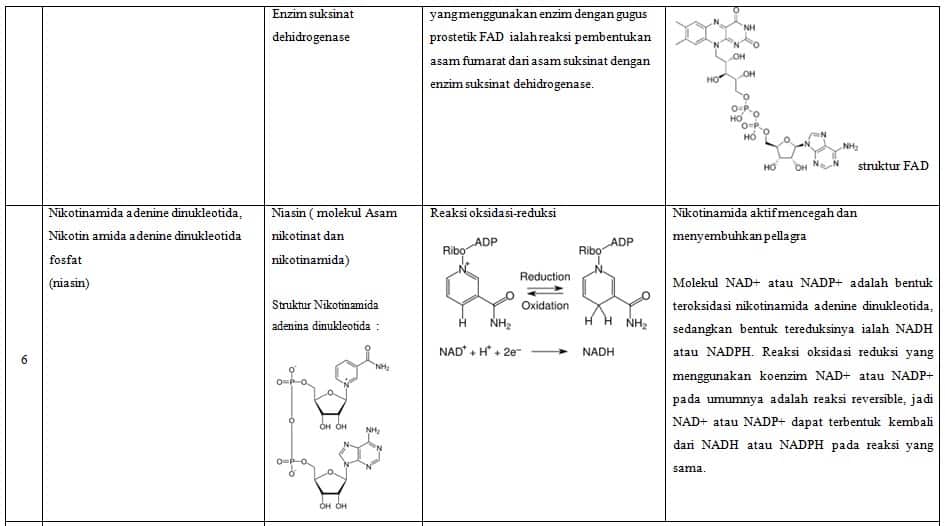
Selama reaksi, kompleks kelompok enzim prostetik dapat mengalami perubahan struktural, tetapi mereka masuk ke keadaan semula ketika reaksi selesai. FAD ialah kelompok enzim prostetik dehidrogenase suksinat yang mereduksi ke FADH2 dalam proses konversi suksinat menjadi fumarat.
Koenzim
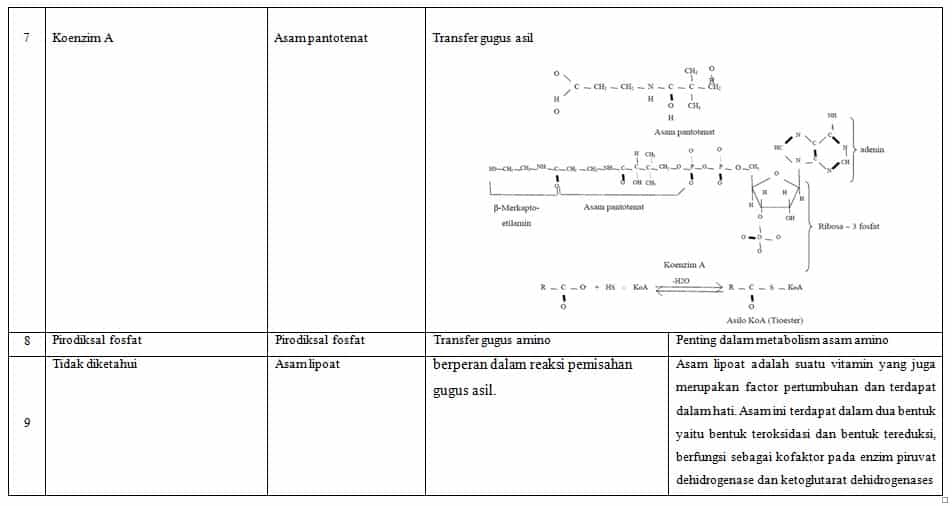
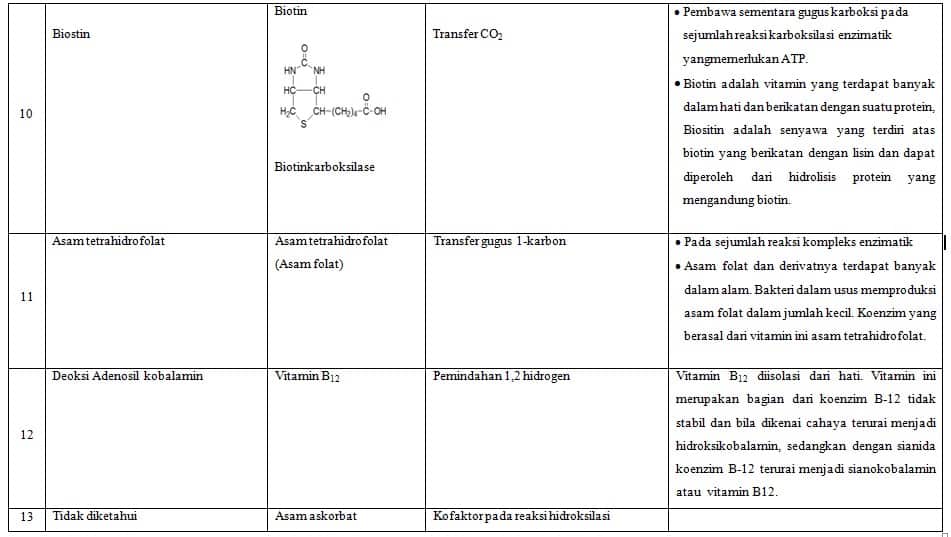
Koenzim ialah molekul organik kecil dari enzim (yang merupakan protein), koenzim terutama molekul organik dan banyak yang berasal dari vitamin. Sebagai contoh, niacin menghasilkan NAD + Koenzim yang bertanggung jawab untuk reaksi oksidasi. Selanjutnya, koenzim A terbuat dari asam pantotenat dan mereka berpartisipasi dalam reaksi sebagai pembawa gugus asetil.
Koenzim adalah berupa molekul organic yang mentranspor gugus kimia atau electron dari satu enzim ke enzim yang lain, molekul organiK itu terikat pada bagian protein enzim. Kofaktor enzim berfungsi sebagai pembawa sementara atom spesifik atau gugus fungsional. Contoh koenzim : NADH, NADPH dan adenosina trifosfat
Gugus kimiawi yang dibawa mencakup:
- Ion hidrida (H–) yang dibawa oleh NAD atau NADP+,
- Gugus asetil yang dibawa oleh koenzim A
- Formil, metenil dibawa oleh asam folat,
- Gugus metil yang dibawa oleh Sadenosilmetionina.
Beberapa koenzim seperti riboflavin, tiamina, dan asam folat adalah vitamin. Sifat-sifat koenzim:
- Senyawa organik
- Tahan panas,
- Mudah terdisosiasi
- Dapat dipisahkan dari enzimnya dengan cara dialisis
- Mentranspor gugus kimia/elektron dari 1 enzim ke enzim lainnya
Contoh : NAD,NADP,FAD,FMN,dll
- Dapat memperbesar kemampuan katalitik sebuah enzim besar dari kemampuannya sendiri.
- Jenis reaksi yang sering memerlukan koenzim:
1. oksidasi reduksi
2. reaksi pemindahan gugus
3. isomerasi
Koenzim yang berikatan secara erat dengan enzim lewat ikatan kovalen atau gaya nonkovalen kerap kali disebut sebagai gugus prostetik. Koenzim yang mampu berdifusi secara bebas umumnya berfungsi sebagai unsur pembawa (yang didaur ulang secara kontinu) hydrogen (FADH), hidrida (NADH dan NADPH), atau unit-unit kimia seperti gugus asil (koenzim A) atau gugus metil (folat), membawanya bolak-balik antara tempat pembentukannya dan pemakaiannya. Oleh karena itu, koenzim yang disebut sebagai substrat sekunder. Jenis-jenis enzim yang membutuhkan koenzim adalah enzim yang mengatalisis reaksi oksidasireduksi, pemindahan gugus serta isomerisasi, dan reaksi yang membentuk ikatan kovalen.
Peranan dan Fungsi Koenzim
Kofaktor berperananan baik membantu proses katalisis oleh enzim maupun penyusunan struktural yang penting. Fungsi kofaktor pada umumnya adalah untuk memantapkan ikata n antara subtract pada enzim atau mentransfer electron yang timbul selama katalisa.
Pembagian kofaktor:
- Aktivator adalah ion anorganik yang biasanya berikatan lemah dengan suatu enzim
Contoh; Cu,Fe,Mn,Zn.Ca,K dan Co - Gugus Prostetik ikatan kovalen
Dapat berupa senyawa organik tertentu, vitamin / ion logam.
Contoh:
– FAD Vitamin B2/Riboflavin menerima atom hidrogen
– Ion Logam: Sitokrom sebagai pembawa elektron pada Fe
Enzim yang Mengandung atau Memerlukan Unsur Anorganik Esensial sebagai Kofaktor
| No | Kofaktor | Enzim | Fungsi | Keterangan |
| 1 | Fe2+ atau Fe3+ | Oksidase sitokhrom Katalase Peroksidase | · Berperan dalam absorbsi besi. Mengkatalisis oksidasi dan reduksi sithokrom oleh molekul oksigen · Menetralkan H2O2 yang merupakan sisa-sia metabolism saat oksidasi · Katalisator reaksi reduksi H2O2 dengan kopling reduksi sebagai substrak lain | Unsur besi merupakan komponen utama dari hemoglobin (Hb), sehingga kekurangan besi dalam pakan akan mempengaruhi pembentukan Hb |
| 2 | Cu2+ | Oksidase sitokhrom Tironase | · Tirosinase mengkristalisasi reaksi oksidasi tirosin menjadi pigmen melanin | Tembaga berperan dalam aktivitas enzim pernapasan,sebagai kofaktor bagi enzim tirosinase dan sitokrom oksidase. Tirosinase mengkristalisasi reaksi oksidasi tirosin menjadi pigmen melanin (pigmen gelap pada kulit dan rambut) |
| 3 | Zn2+ | Polimerase DNA Anhidrase karbonik Dehidrogenase alcohol | · Bekerja pada reaksi pembentukan aldehida dari alkohol | |
| 4 | Mg2+ | Heksokinase 6-Fosfatase glukosa | · Mengkatalisa pemindahan gugus fosfat dari ATP ke glukosa | |
| 5 | Mn2+ | Arginase | · Mengkatalisis hidrolisis arginin | |
| 6 | K+ | Kinase piruvat (juga memerlukan Mg2+) | · Metaloenzim yang mengkatalisis reaksi dari phospoenol piruvat dan ADP menjadi ATP | |
| 7 | Ni2+ | Urase | · Mengkatalisis hidrolisis urea | |
| 8 | Mo | Reduktase nitrat | · Mengkatalisis perubahan senyawa nitrat (NO3–) menjadi NO2– | |
| 9 | Se | Peroksidase glutation | ||
| 10 | Cl dan Ca | Amilase | Memecah patiuntuk menghasilkan gula sederhana | Amilase dalam ludah akan bekerja lebih baik dengan adanya ion klorida dan kalsium. |
Koenzim Berfungsi Sebagai Pembawa Sementara Atom Spesifik Atau Gugus Fungsionil
| No | Koenzim | Senyawa yang dipindahkan |
| 1 | Tiaminn pirofosfat | Aldehida |
| 2 | Flavin adenine dinukleotida | Atom Hidrogen |
| 3 | Nikotinamida adenine dinukleotida | Ion Hidrida (H+) |
| 4 | Koenzim A | Gugus asil |
| 5 | Piridoksal fosfat | Gugus amino |
| 6 | 5’-Deoksiadenosilkobalamin (Koenzim B12) | Atom H dan gugus alkil |
| 7 | Biostin | CO2 |
| 8 | Tetrahidrofolat | Gugus satu-karbon lainnya |
Peranan Koenzim Pada Vitamin
Perbedaan Koenzim Dan Kofaktor
Berdasarkan strukturnya, enzim terdiri atas komponen yang disebut apoenzim yang berupa protein dan gugus protetik berupa non protein.Gugus prostetik dibedakan menjadi koenzim dan kofaktor.
Koenzim
Gugus koenzim tersusun dari senyawa organik nonprotein yang tidak melekat erat pada bagian protein enzim. Fungsi koenzim adalah membantu proses katalisis oleh enzim maupun penyusunan struktural yang penting. Koenzim digunakan untuk memantapkan ikatan antara substrat pada enzim atau mentransfer elektron yang timbul selama proses katalisa. Contoh koenzim adalah NADH, NADPH dan adenosina trifosfat.
Gugus kimiawi yang dibawa mencakup :
- Ionhidrida(H –) yang dibawa olehNAD atau NADP+
- Gugus asetil yang dibawa oleh koenzim A
- Formil, metenil dibawa oleh asam folat
- Gugus metil yang dibawa oleh S-adenosilmetionina.
Ada beberapa koenzim lain seperti riboflavin, tiamina, dan asam folat adalah vitamin.
Koenzim merupakan senyawa organik yang diperlukan untuk aktifitas suatu enzim tertentu yang bersifat termostabil dan memiliki berat molekul rendah.Koenzim akan memperbesar kemampuan katalitik sebuah enzim sehingga menjadi jauh melebihi kemampuan yang ditawarkan hanya oleh gugus fungsional asam aminonya, yang menyusun massa enzim tersebut.
Koenzim yang berikatan secara erat dengan enzim lewat ikatan kovalen atau gaya nonkovalen kerap kali disebut sebagai gugus prostetik. Koenzim yang mampu berdifusi secara bebas umumnya berfungsi sebagai unsur pembawa (yang didaur ulang secara kontinu) hydrogen (FADH), hidrida (NADH dan NADPH), atau unit-unit kimia seperti gugus asil (koenzim A) atau gugus metil (folat), membawanya bolak-balik antara tempat pembentukannya dan pemakaiannya. Oleh karena itu, koenzim yang disebut sebagai substrat sekunder.
Jenis-jenis enzim yang membutuhkan koenzim adalah enzim yang mengatalisis reaksi oksidasireduksi, pemindahan gugus serta isomerisasi, dan reaksi yang membentuk ikatan kovalen.
Kofaktor
Kofaktor berfungsi sama dengan gugus prostetik, tetapi berikatan secara reversible Dapat berupa zat anorganik
- ion logam (Metal- activated enzymes)
Dapat berupa zat organik - flavin dan heme
Contoh enzim yg mengandung kofaktor; karbonat anhidrase dg kofaktor Zn terikatsbg bgn dari tapak aktifnya ->katalitik
Koenzim berupa gugus organik yang padaumumnya merupakan vitamin, seperti vitamin B1, B2, NAD+ (Nicotinamide Adenine Dinucleotide ). Kofaktor berupa gugus anorganik yang biasanya berupa ion-ion logam, seperti Cu2+, Mg2+, dan Fe2+
Kofaktor adalah komponen enzim yangbersifat non-protein yang berfungsimengaktifkan enzim.
Sifatnya stabil terhadap perubahan suhuatau suatu reaksi.
Kofaktor dibedakan menjadi tiga tipe yaitu, aktivator, gugus prostetik dan ko-enzim
- Aktivator
Aktivator adalah ion – ion anorganik yangbiasanya berikatan lemah dengan suatuenzim. Contoh beberapa logam berperansebagai aktivator dalam sistem enzimadalah Cu, Fe, Mn, Zn, Ca, K dan Co. - Gugus Prostetik
Gugus prostetik berikatan erat denganenzim (protein) oleh ikatan kovalen.Gugus prostetik dapat berupa senyawaorganik tertentu, vitamin atau ion logam.Misal FAD yang mengandung riboflavin (Vitamin
B2) yang merupakan bagian FADyang menerima atom Hidrogen. - Koenzim
Enzim yang tidak mempunyai gugusprostetik, memerlukan senyawa organiklain untuk aktivitasnya juga disebutkoenzim. Koenzim tidak melekat erat padabagian protein enzim.
Komponen non-protein yang membantu aktivitas katalitik dapat berupa kofaktor,koenzim, dan gugus protetis.
Ketiganya mempunyai persamaan yaitu : Membantu enzim dalam melakukanfungsi katalitik, tetapi tidak mempunyai kemampuan katalitik.
Perbedaan Kofaktor dan Koenzim
- Koenzim ialah molekul organik, sedangkan kofaktor dapat anorganik juga.
- Koenzim terikat longgar dengan enzim dan ada beberapa kofaktor lainnya yang terikat erat pada enzim.
- Sebuah koenzim adalah jenis kofaktor. Ini adalah kofaktor yang terikat longgar ke enzim.
- Kofaktor adalah senyawa kimia yang terikat pada protein.
- Sebuah kofaktor adalah senyawa kimia non-protein, sedangkan koenzim adalah molekul non-protein.
Koenzim dan Vitamin
- Kofaktor dibutuhkan oleh apoenzim inaktif (hanya protein) untuk diubah menjadi holoenzim aktif.
- Ada dua jenis kofaktor yaiu ion esensial (biasanya ion logam) dan komponen organi yang biasa disebut koenzim. Keduanya memiliki kegunaan yang sama pada sisi aktif pada enzim yang bersangkutan.
- Mineral merupakan kofaktor. Beberapa ion esensial merupakan ion aktivator yang terikat secara reversibel dan sering terlibat dalam pengikatan substrat sedangkan kation (metaloenzim) terikat kuat dan hanya kadang-kadang saja terlibat secara langsung dalam reaksi katalisis
- Koenzim bereaksi sebagai reagen gugus traansfer yang spesifik pada gugus kima yang dapat menerima dan mendonor. Beberapa koenzim, gugus hidrogen atau sebuah elektron, beberapa koenzim dapat mengangkut lebih banyak dan terikat secara kovalen dengan gugus kimia.
- Gugus metabolit terikat pada pusat rektif dari koenzim
- Pada mamalia terdapat koenzim yang merupakan turunan dari prekursor makanan yang disebut vitamin.
Enzim Membutuhkan Kation Anorganik
- Enzim membutuhkan kation metal untuk mencapai aktivitas katalitik lengkap.
- Enzim dibedakan menjadi 2 tipe yaitu enzim yang diaktivasi oleh logam dan metaloenzim. Enzim yang diaktivasi oleh logam membutuhkan penambahan iom logam atau distimulasi oleh penambahan ion logam. Bebrapa enzim membutuhkan kation monovalen seperti K+ atau divalen seperti Ca2+ atau Mg2+. Contoh:kinase membutuhkan ion Mg2+ untuk membentuk kompleks magnesium- ATP dan menggunakan gugus fosforil substrat. Magnesium diserang oleh gugus fosfat pada ATP melalui muatan negatifnya sehingga lebih rentan terhadap serangan nukleofilik.
- Metaloenzim terikat kuat pada ion metal di sisi aktifnya. Ion yang paling umum ditemukan pada mealoenzim adalah logam transisi sepertibesi dan zink dan juga Cu dan Co.
- Ion logam yang terikat kuat pada enzim biasanya memiliki peran penting pada reaksi katalisis. Ion dari beberapa metaloenzim dapat bertindak sebagai katalis elektrofilik yaitu dengan menarik elektron sehingga ikatan dapat terpolarisasi. Contoh: enzim karbonat anhidrase adalah elektrofilik atom zink yang terikat dengan rantai samping dari tiga residu histidin dan sebuah molekul air karena air terionisasi dengan mudah. Gugus karboksilat dasar dari enzim melepaskan sebuah proton dari ikatan molekul air menghasilkan ion hidroksida nukleofilik yang menyerang substrat. Enzim ini memiliki laju katalisis yang sangat tinggi karena kesederhanaan mekanismenya. Banyak metaloenzim zink lain yang mengaktivasi ikatan molekul air pada cara ini.
Klasifikasi Koenzim
- Diklasifikasikan menjadi 2 tipe berdasarkan interaksi dengan apoenzim yaitu kosubstrat dan gugus prostetik.
- Kosubstrat adalah substrat pada enzim yang mengkatalisis reaksi dengan cara mengubah jalan reaksi dan mendisosiasi sisi aktif. Struktur awal dari kosubstrat diregenerasi oleh reaksi lanjutan yang dikatalisis oleh enzim lain. Kosbstrat dapat didaur ulang berkali-kali didalam sel, tidak seperti substrat biasa yang produknya secara khas mengalam perubahan lebih lanjut. Kumparan kosubstrat gugus metabolit aktif berbeda dengan enzim yang mengkatalisis reaksi.
- Gugus prostetik terikat pada enzim selama jalannya reaksi, pada beberapa hal gugus prostetik terikat secara kovalen pada apoenzim yang pada kasus lain gugus prostetik terikat kuat pada sisi aktif dengan interaksi lemah. Seperti residu asam amino ionik pada sisi aktif , gugus prostetik akan kembali pada bentuk asalnya.
- Kosubstrat dan gugus prostetik merupakan bagian dari sisi aktif yang tdak terdapat pada rantai samping residu asam amino.
- Prokariot, protista, fungi, dan tumbuhan dapat mensintesis sendiri koenzim dari prekursor sedangkan mamalia membutuhkan sumber koenzim untuk bertahan hidup yang disuplai dari nutrisi (biasanya dalam jumlah kecil) yang disebut vitamin.
- Sumber utama vitamin dari tumbuhan dan organisme meskipun binatang karnivora dapat memenuhi vitamin dari daging. Sebagian besar vitamin akan diubah secara enzimatik menjadi koenzim koresponden
- Penyakit karena kekurangan nutrisi dapat terjadi saat vitamin sedikit atau tidak ada pada makanan seekor hewan namun dapat diatasi dan dicegah dengan mengkonsumsi vitamin yang tepat. Pemulihan dari penyakit tersebut telah digunakan untuk menguji potensi ekstrak selama isolasi vitamin.
- Sebagian besar vitamin akan dikonversi menjadi koenzim setelah bereaksi dengan ATP. Banyaknya molekul ATP yang ditransfer pada vitamin merupakan gugus yang mengikat koenzim pada sisi aktif enzim.
- Kata vitamin diciptakan oleh Casimir Funk pada tahun 1912 untuk mendeskripsikan “vital amin” dari sekam beras yang menyembuhkan penyakit beri-beri (penyakit kekurangan nutrisi yang berakibaat pada kemunduran syaraf). Beri-beri pertama kali ditemukan pada burung. Substansi anti beri-beri (tiamin) dikenal sebagai vitamin B1.
- Dua klasifikasi vitamin: vitamin larut air (seperti vitamin B) dan vitamin larut lemak (vitamin lemak). Vitamin larut air dibutuhkan tiap harinya dalam jumlah yang sedikit karena vitamin ini dieksresi dengan cepat pada urin dan penyimpanan selular dan koenzimnya tidak stabil. Vitamin larut lemak seperti vitamin A, D, E, K disimpan oleh hewan dan kelebihan asupan vitamin dapat berakibat toksik yang disebut hiperavitaminosis.
Klasifikasi dan Jenis kofaktor
Untuk aktivitasnya (kadang-kadang) enzim membutuhkan kofaktor, yang berupa senyawa organik berbobot molekul tinggi atau logam. Komposisi enzim terdiri: senyawa organic ber BM tinggi dan senyawa logam. Sejumlah enzim, membutuhkan komponen tambahan untuk dapat berfungsi sebagai katalis. Komponen tersebut disebut kofaktor.
Kofaktor dibedakan menjadi tiga kelompok:
- Gugus prostetik yaitu kelompok kofaktor yang terikat kuat oleh enzim, dan tidak mudah dilepas dari enzim tsb.
Contoh: Flafinadenin Nukleotida, merupakan gugus prostetik yang terikat pada enzim suksinat dehidrogenase. - Koenzim, molekul organic kecil, tahan terhadap panas, mudah terdisosiasi dan dapat dipisahkan dengan dengan enzimnya dengan cara dianalisis.
Contohnya: NAD, NADP, ATP, Asam tetra dihidrofosfat. - Aktifator yaitu ion-ion logam yang berperan dalam aktifasi enzim.
Contoh: ion K+ ; Mn ++ ; Cu ++; Mg++ dan ion Zn ++
( Ingatkan Perhatian anda pada Pupuk makro dan pupuk mikro).
Logam yang berfungsi dalam katalisa
| Logam | Nama Enzim |
| Zn ++ | Alcohol dehidrogenase |
| Fe ++ | Sitokrom katalase |
| K+ | Pirufat fosfokinase |
| Mg++ | Fosfotranferase |
Senyawa logam:
- Berfungsi untuk memantapkan ikatan antara subtract dengan enzim atau mentranfer electron yang timbul selama proses katalisa berlangsung.
- Berfungsi sebagai kofaktor
Dari ketiga kelompok kofaktor tersebut, peranan koenzim dan gugus prostetik bersamaan dengan vitamin bekerja secara simultan.
Vitamin adalah golongan senyawa kimia terdapat dalam jumlah sedikit, namun mempunyai arti sangat penting, sebab kekurangan vitamin akan menimbulkan beberapa jenis penyakit.
Berdasar kelarutannya vitamin dibedakan:
- Vitamin larut dalam air: memiliki sifat mudah diserab oleh usus dan mudah dikeluarkan melalui urine.
Contoh: Vitamin B komplek (B1, B2, B3, B6, B12 dan vit C). - Vitamin larut dalam dalam lemak (vit A, D, E, dan K)
Pada umumnya koenzim dan gugus properties yang membantu enzim termasuk dalam golongan vitamin
Vitamin sebagai kofaktor
| Nama | Vitamin | Fungsi |
| Nikotiamida adenine Dinukleotida | Asam Nikotinat | Dehidroginasi |
| Flavin Mono Nukleotida | Vitamin B2 | Dehidroginasi |
| Tiamin Piro fosfat | Vitamin B1 | Transfer asil |
| Lipoil lisin | Asam lipoat | Transfer sail |
| Biositin | bioti | Karboxilasi |
| Piridoksal-P | Vitamin B6 | Transfer NH2 |
| Koenzim A | Asam pantotenat | Transfer asil |
Artikel Terkait
- Jelaskan Perbedaan Antara Pertumbuhan dan Perkembangan
- Kelompok Tumbuhan yang Menunjukkan Keanekaragaman Tingkat Gen Terdapat Pada
- Senjata Biologi Bakteri yang Menginfeksi Hewan Ternak dan Dapat Menular ke Manusia Antara Lain
- Tumbuhan Yang Berkembang Biak Dengan Tunas
- Cabang Ilmu Biologi yang Mempelajari Tentang Hewan Adalah
- Hewan Mamalia Berkembangbiak dengan Cara Apa?
- Hasil dari Peristiwa Glikolisis Adalah?
- Mengapa Tumbuhan Memerlukan Energi Matahari
- Alat Kelamin Jantan Pada Bunga Dinamakan
- Peredaran darah dari jantung ke paru-paru kembali lagi ke jantung disebut